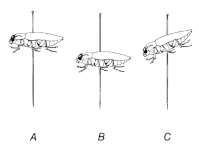
Standardní preparace vysušením
Standardně se brouci preparují téměř výhradně vysušením. Tím se dokonale zakonzervují. V rámci preparace vysušením provádíme následující základní úkony:
- příprava exempláře před preparací (je-li exemplář před preparací vysušený, musíme ho znovu zvláčnit);
- očištění celého těla (exemplář zbavíme nečistot, popř. i mastnoty);
- vyrovnání (srovnání zkrouceného těla do roviny);
- úprava nohou a tykadel podle způsobu metody preparace;
- upevnění exempláře;
- vysušení preparátu;
- opatření lokalitním štítkem.
Dále si jednotlivé úkony popíšeme podrobněji.
1. Příprava exempláře před preparací
Jak už bylo uvedeno v předchozích kapitolách, exempláře uchováváme po sběru buď ve vláčném stavu, v parách octanu etylnatého nebo v mrazicím boxu a nebo jako vysušené.
Vláčné exempláře
Pokud máme exemplář ve vláčném stavu, můžeme přistoupit k dalšímu kroku preparace. V takovém případě brouky preparujeme 2. až 3. den po jejich usmrcení, to jsou nejvláčnější. Okamžitě po usmrcení mohou být ještě „v křeči“ a preparace by mohla být obtížná. Brouky můžeme ovšem udržovat v parách octanu vláčné až po dobu 1 roku. Pozor však na některé barevné jedince, kteří mohou již po několika hodinách ztrácet barvu (viz kapitola Základní metody a nástroje sběru). Pokud uchováváme exempláře v parách octanu etylnatého delší dobu, musíme v lahvičce udržovat jeho koncentraci, tj. obvykle vždy po několika dnech přidat pár kapek octanu (podle toho, jak daná lahvička dobře těsní). Pokud na to zapomeneme, je často nutné před vlastní preparací exempláře zvláčnit v rozvlhčovadle, stejně jako v případě úplně vyschlých jedinců. Doba rozvlhčování je u částečně vyschlých exemplářů poněkud kratší – obvykle můžeme takové jedince preparovat už po 10 až 12 hodinách.
Zamrazené exempláře
Zamrazené exempláře vyjmeme z mrazicího boxu a necháme je při pokojové teplotě cca 60 minut rozmrazit. Po této době jsou již vláční a připraveni k dalšímu kroku preparace.
Vysušené exempláře
Vyschlé exempláře musíme nejprve zvláčnit. To provádíme v nádobě, které říkáme rozvlhčovadlo. Tím může být jakákoli nižší miska, kterou lze přikrýt víčkem nebo nějakým poklopem. Velmi vhodné jsou k tomuto účelu Petriho misky. Já na dno misky položím cca 4 vrstvy papírových kuchyňských utěrek, které nastříhám na velikost používané misky. Pomocí kapátka nebo střičky vrstvu z utěrek jemně navlhčím a zakápnu několika kapkami 10% octa nebo dezinfekce Ajatin - to jako ochranu proti případnému bujení plísní. Do takto připraveného rozvlhčovadla opatrně vložím sběr, misku zavřu a nechám brouky pomalu rozvlhčovat. Počítejte s tím, že při pokojové teplotě může rozvlhčování trvat cca 24 hodin. Asi po 10-15 hodinách rozvlhčování můžeme s brouky již jemně manipulovat a můžeme trochu přikápnout vody. Po 24 až 36 hodinách bývají brouci již dostatečně rozvlhčení a připravení k dalším preparačním úkonům. Pokud máme v rozvlhčovadle různé typy exemplářů, je nutné si uvědomit, že jemné exempláře budou rozvlhčeny podstatně dříve než velké či více chitizované druhy. Proto je vhodné jemné exempláře preparovat přednostně, abychom se vyhnuli nebezpečí jejich převlhčení.
Rychlý způsob rozvlhčení vysušených exemplářů spočívá v jejich ponoření na 30 minut do Barberova roztoku. Barberův roztok je směs s následujícím složením:
- 1 000 ml 95% etanolu,
- 1 000 ml destilované vody,
- 375 ml etylacetátu (octanu etylnatého),
- 125 ml benzenu.
Přibližně po 30 minutách pobytu v Barberově roztoku jsou brouci rozvlhčeni tak, aby je bylo možné preparovat.
Problémové exempláře
Někdy se stává, že i po kvalitně provedeném rozvlhčení jsou někteří jedinci stále neschopni provedení preparace. Obvykle se to děje u jedinců, kteří se do naší sbírky dostali odjinud a byli tzv. „špatně usmrceni“ (např. při použití nevhodné smrtící látky) nebo u některých hodně sklerotizovaných jedinců. Náchylní bývají často zástupci čeledi Curculionidae. V takových případech je nutné rozvlhčit jedince poněkud hrubším způsobem, ale i tak nikdy nevíme, zda výsledkem bude dobře preparovatelný exemplář.
Rozvlhčení takových „problémových exemplářů“ můžeme zkusit vložením jedince do vařící vody. Přitom dáváme pozor, aby se rozvlhčovaný jedinec neotlouklal o stěny nádoby. Přibližně po 30-60 minutách vaření exemplář vyjmeme a zkusíme, zda trochu „změkl“. Pokud ne, zkusíme přidat do nádoby trochu kyseliny octové a ve vaření pokračovat dalších 30-60 minut. Pokud ani to nepomůže, pokusíme se ještě takového jedince rozvlhčit tlakem oxidu uhličitého. To provedeme následujícím způsobem.
Vezmeme si širokohrdlou lahev s dobře těsnícím uzávěrem. Do lahve nalijeme trochu octa a doplníme ji sodovou vodou až po spodní okraj hrdla. Co nejrychleji vložíme rozvlhčované jedince a láhev uzavřeme. Exempláře bývají rozvlhčeni po 15 až 60 minutách – podle jejich velikosti a stupně sklerotizace. Exempláře neponechávejte v roztoku déle než 90 minut, protože hrozí nebezpečí jejich převlhčení. Rozvlhčovací efekt je velmi silný a metoda se hodí zejména pro větší a silněji sklerotizované jedince. Pokud ani tento způsob rozvlhčení nepomůže, musíme se smířit s tím, že daný jedinec nepůjde dobře zpreparovat.
2. Očištění celého těla exempláře
Běžné čištění většiny exemplářů spočívá v jejich opatrném očištění pomocí jemného štětečku, přičemž velikost štětečku by měla odpovídat čištěnému exempláři. Na jemné a menší jedince použijeme menší a jemnější štěteček (např. velikost 0 až 2) ve srovnání s většími a více sklerotizovanými jedinci (např. velikost 4 až 12). V případě většího znečištění namočíme štěteček do roztoku mýdlové vody.
U jedinců, kteří jsou mastní, použijeme k odmaštění některé z rozpouštědel, jako je etylacetát, benzen, éter či alkohol. Očištění od mastnoty může u některých jedinců způsobit pozitivní efekt, spočívající v jemném projasnění zbarvení daného exempláře.
Pokud se nám dostanou do rukou exempláře, které potřebujeme očistit od plísní, použijeme k tomu chroroform nebo etylacetát. Čištění od plísní bývá ale vždy problematické a s nejistým výsledkem.
Další kroky preparace provádíme již na preparační destičce.
3. Vyrovnání exempláře
Prvním krokem práce na preparační destičce je základní srovnání exempláře. To provedeme pomocí přiměřeně velkého štětečku nebo pomocí preparační jehly. Preparovaný exemplář srovnáme do roviny tak, aby nebyl prohnutý či jinak zkroucený.
4. Úprava nohou a tykadel
Provedeme základní úpravu nohou a tykadel podle zvolené metody preparace vysušením: napíchnutí na entomologický špendlík nebo nalepení na štítek. Při úpravě si exemplář položíme na preparační destičku břišní stanou nahoru.
V případě metody „napíchnutí na entomologický špendlík“ srovnáme končetiny tak, aby směřovaly co nejméně od těla – přední nohy směrem dopředu, prostřední a zadní nohy směrem dozadu, nikoli do stran. Tykadla srovnáme podél těla tak, aby směřovala směrem dozadu.
V případě metody „nalepení na štítek“ srovnáme končetiny tak, aby směřovaly co nejdále od těla. Jsou-li tykadla krátká, můžeme je srovnat tak, že budou směřovat směrem dopředu. Dlouhá tykadla srovnáme podél těla. Směrem dopředu narovnáme též makadla, popř. u dravých exemplářů též rozevřeme kusadla. Při práci si exemplář přidržíme krycím sklíčkem na fixaci exempláře a srovnání končetin a ostatních přívěsků provádíme preparační jehlou nebo štětečkem.
5. Upevnění exempláře
Jak už bylo v předchozím bodě uvedeno, používáme při tomto způsobu preparace dvě základní metody:
- napíchnutí na entomologický špendlík
- nalepení na štítek
Neexistuje žádný předpis či norma, která by nám říkala, kdy máme použít některou z těchto dvou metod. Obecné pravidlo zní, že velké exempláře napichujeme a malé exempláře nalepujeme. Hranici mezi velkým a malým exemplářem si však musí každý určit sám. V současné době převažuje názor, že prioritu má nalepení na štítek. Převládá estetické hledisko, kdy mnozí entomologové tvrdí, že propíchnutím krovky se vlastně takový exemplář poškodí. Z vědeckého hlediska tento argument neobstojí, protože obal broučího těla je symetrický a k vědeckému studiu nám stále zůstává druhá, nepoškozená krovka. Já osobně jsem se setkal v zahraničních muzeích i s napíchnutými exempláři o velikosti cca 5 mm. Pro ty z vás, kteří s entomologií teprve začínají, uvádím hranice, které jsem si stanovil já:
- napíchnutí na entomologický špendlík aplikuji na exempláře, kteří jsou větší než 15 mm;
výjimkou jsou třeba zástupci čeledi Staphylinidae (drabčíkovití), u kterých nalepuji na štítek i velké exempláře; - exempláře do 15 mm potom nalepuji na štítek;
navíc, u exemplářů menších než 3 mm, někdy aplikuji metodu vytvoření mikroskopického preparátu uzavřením do vzduchové komůrky (viz dále).
Napíchnutí na entomologický špendlík
 Podle velikosti a tuhosti skeletu preparovaného exempláře si vybereme entomologický špendlík vhodné velikosti. Naprostou většinu českých brouků lze napichovat na špendlíky velikosti 2 nebo 3. Špendlíky velikosti 1 použijeme výjimečně na tenké exempláře nebo na preparované jedince, kteří mají velmi jemný skelet (mají měkké krovky). Naopak špendlíky velikosti 4 využijeme na ty největší jedince, kteří mají velmi tvrdé krovky. Obvykle s nimi napichujeme exempláře o velikosti větší než 35 mm.
Podle velikosti a tuhosti skeletu preparovaného exempláře si vybereme entomologický špendlík vhodné velikosti. Naprostou většinu českých brouků lze napichovat na špendlíky velikosti 2 nebo 3. Špendlíky velikosti 1 použijeme výjimečně na tenké exempláře nebo na preparované jedince, kteří mají velmi jemný skelet (mají měkké krovky). Naopak špendlíky velikosti 4 využijeme na ty největší jedince, kteří mají velmi tvrdé krovky. Obvykle s nimi napichujeme exempláře o velikosti větší než 35 mm.
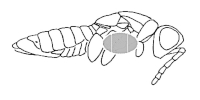
Srovnaný exemplář podle bodu 3 a 4 si položíme na preparační destičku krovkami nahoru a vpich špendlíku vedeme kolmo doprostřed prvé třetiny pravé krovky (viz obrázek). Přitom si exemplář fixujeme rukou k podložce. Dáme si opravdu záležet na tom, aby byl špendlík veden kolmo k ose těla, protože na správném napíchnutí závisí konečný vzhled preparovaného exempláře. Při vpichu dáváme pozor, abychom špendlíkem nevymáčkli kyčel nohy z její prohlubně. Špendlík zasuneme do těla preparovaného exempláře tak, aby nad tělem vyčníval nejméně 1 cm.
Nyní tvrdou pinzetou vezmeme preparovaný exemplář a vsuneme hlavičku špendlíku do výškáčku, do otvoru 10 mm. Pinzetou nyní tlakem na břišní stranu posuneme napíchnutý exemplář po špendlíku tak, aby mezi koncem špendlíku s hlavičkou a preparovaným exemplářem zůstal prostor právě 10 mm. Tím máme preparovaný exemplář výškově nastaven. Špendlík s exemplářem nyní zapíchneme do preparační destičky tak, že se exemplář dotýká břišní stranou destičky. Pozor, abychom si při této manipulaci neposunuli exemplář po špendlíku, protože bychom si narušili výškové nastavení exempláře a museli bychom ho pomocí výškáčku opravit.
Nyní provedeme konečné srovnání končetin, tykadel a makadel. Přitom si pomáháme fixačními špendlíky, kterými exemplář „obpícháme“. Končetiny srovnáme pod tělo tak, že u středních a zadních nohou vyčnívají jen klouby mezi stehny a holeněmi a přední nohy jsou složené vedle hlavy a směřují dopředu. Tykadla srovnáme podél těla směrem dozadu. Makadla směřují směrem dopředu. Kusadla preparovaného exempláře můžeme mírně rozevřít.
Popsaný způsob preparace napíchnutím je vhodný pro vědecké sbírky, ve kterých se preferuje ochrana exempláře před poškozením a je kladen důraz na to, aby exempláře ve sbírce nezabírali tolik místa. Pokud budujete sbírku především pro prezentaci, potom se při takové preparaci více hledí na to, aby bylo z preparovaného exempláře co nejvíce vidět. To znamená, že se končetiny nezakládají tolik pod tělo, ale srovnají se spíše podél těla.
K takto vypreparovanému exempláři umístíme lístek s informacemi o sběru – základ pro budoucí lokalitní štítek. Někdy se již v této etapě přímo k exempláři připojí vytištěný lokalitní štítek.
Nalepení na štítek
 Zkontrolujeme u exempláře, zda jsou končetiny i ostatní přívěsky srovnané podle bodu 4. Preparát obrátíme krovkami nahoru a opět zkontrolujeme souměrnost srovnání končetin i všech přívěsků. Závady odstraníme jemným štětečkem nebo pinzetou za současné fixace preparátu pomocí přípravku z krycího sklíčka. Nohy upravíme tak, aby byly dobře viditelné po stranách těla a působily přirozeným dojmem – brouk musí vypadat, jako když leze.
Zkontrolujeme u exempláře, zda jsou končetiny i ostatní přívěsky srovnané podle bodu 4. Preparát obrátíme krovkami nahoru a opět zkontrolujeme souměrnost srovnání končetin i všech přívěsků. Závady odstraníme jemným štětečkem nebo pinzetou za současné fixace preparátu pomocí přípravku z krycího sklíčka. Nohy upravíme tak, aby byly dobře viditelné po stranách těla a působily přirozeným dojmem – brouk musí vypadat, jako když leze.
Nyní vybereme nalepovací štítek vhodné velikosti. Preparát se musí na štítek vejít, žádná z částí těla nemá přesahovat přes okraj štítku. Na druhou stranu by štítek neměl být příliš velký, aby se na něm preparát „ztrácel“. Na štítek naneseme kapku lepidla – použijeme k tomu např. entomologický špendlík s uříznutou hlavičkou. Lepidlo nanášíme tak, aby bylo umístěné mezi kyčlemi prvního a druhého páru nohou (viz obrázek). Poté preparát přemístíme na štítek s lepidlem.
Pokud přesunem preparátu na štítek s lepidlem došlo k nějakému posunu nohou, můžeme opatrně provést korekci, přičemž si preparát přidržujeme krycím sklíčkem na fixaci exempláře. Finální korekci potom provedeme až po dostatečném zaschnutí lepidla (10 – 20 minut).
Nakonec štítek propíchneme špendlíkem (nejlepší zkušenosti mám se špendlíky velikosti 3, na kterých drží nalepovací štítek dostatečně pevně) a upravíme pomocí výškáčku výšku preparovaného exempláře na hodnotu 25 mm. Hotový preparát přemístíme na místo, určené pro závěrečné sušení.
K takto vypreparovanému exempláři umístíme lístek s informacemi o sběru – základ pro budoucí lokalitní štítek. Někdy se již v této etapě přímo k exempláři připojí vytištěný lokalitní štítek.
Po získání určitých zkušeností s preparací provádíme operaci upevnění exempláře obvykle pro více preparátů současně.
6. Vysušení preparátu
Po dokončení bodu 5 nastává fáze sušení preparátu. Délka sušení závisí na velikosti preparátu a klimatických podmínkách, při kterých sušení probíhá.
Při průměrné vlhkosti 50% a teplotě 22°C (běžný panelákový byt) nechávám nalepené exempláře sušit min. 1 týden, napíchnuté exempláře suším cca 1 měsíc. To jsou časy, které jsou více než dostatečné pro kvalitní vysušení preparátu. Uvedené časy by stačily na vysušení i v horších podmínkách, např. při vlhkosti 50 – 60%.
Preparáty sušíme obvykle na místě, kde je zajištěno proudění vzduchu. V zimě to může být například v blízkosti topení. Současně bychom ale též měli zajistit, aby v místě sušení nebyla vyšší prašnost. Tyto zdánlivě protikladné požadavky můžeme splnit např. tím, že umístíme podložky se sušenými preparáty do větší kartonové krabice, kterou občas "vyvětráme".
Po dokončení sušící fáze opatrně odstraníme z napíchnutých exemplářů fixační špendlíky.
7. Opatření lokalitním štítkem
Po dokončení sušící fáze již zbývá jen opatřit preparát lokalitním štítkem s údaji o místě nálezu, datu nálezu a informací, kdo exemplář našel. Toto je velmi důležitá součást preparace, minimálně stejně důležitá, jako kvalitní provedení preparace samotné.
Lokalitní štítek se umisťuje pod vypreparovaný exemplář. U exemplářů, nalepovaných na štítky, se umisťuje ve výšce 21 mm od špičky špendlíku. Brouci napíchnutí na špendlík mají obvykle větší tloušťku a lokalitní lístek se tak umisťuje několik mm pod napíchnutý exemplář – máme-li výškáček, který disponuje i dalšími polohami (17 a 13 mm), umístíme štítek na nejbližší nižší polohu (obvykle 17 mm).
Velikost štítku by u nalepovaných exemplářů měla odpovídat velikosti nalepovacího štítku, resp. by nalepovací štítek neměla příliš přesahovat. To lze poměrně snadno dodržet u větších nalepovacích štítků. U menších štítků se snažíme umístit potřebné údaje na co nejmenší plochu, aby lokalitní štítek přesahoval ten nalepovací jen v míře nezbytně nutné. I když neexistuje žádná norma pro velikost lokalitních štítků, v odborné literatuře bývá jako maximální doporučovaná velikost uváděna hodnota 7 x 18 mm.
Bližší pravidla pro zápis lokalitních štítků najdete na stránce „Nástroje preparace“.
Zvláštnosti preparace rodu Meloe
Preparace rodu Meloe je o něco složitější, protože po bodu 2 výše uvedeného preparačního postupu musíme zařadit bod 2A, který spočívá v rozříznutí zadečku, vybrání jeho obsahu, následném vyčištění a vycpání.
Tělo zástupců rodu Meloe obsahuje velké množství tuku, které by bránilo vyschnutí preparátu při klasické preparaci – došlo by spíše k zahnívání preparátu. Navíc by docházelo i k destrukci zadečku, který je kryt pouze velmi tenkým tělním pokryvem. Z těchto důvodů je třeba zástupce rodu Meloe doslova „vyvrhnout“ a vycpat.
Majku usmrcenou octovým éterem přeneseme na preparační podložku, a to ventrální (břišní) stranou nahoru. Zadeček v podélném směru rozstřihneme jemnými nůžkami nebo rozřízneme skalpelem, a to až k hrudním článkům. Tvrdou pinzetou vybereme olejnatý obsah zadečku a místo něj vsuneme do zadečku vatový tampon. Poté jedince ponoříme do benzinu, kde dojde k odmaštění zbytků tukové tkáně. V případě nutnosti benzin několikrát vyměníme. Když je exeplář dostatečně odmašěný, tampon ze zadečku vytáhneme a po odpaření benzinu (cca 3-5 minut) místo něj opatrně vyplníme dutinu zadečku suchou vatou až do přirozeného tvaru. Vycpávku vkládáme do zadečku po malých kouscích, přičemž jemným tlakem rozprostíráme vatu až do dosažení přirozeného tvaru zadečku. Nakonec jemným tlakem prsty stlačíme rozstřižený otvor, aby vata nevyčnívala.
Po tomto mezikroku pokračujeme v preparaci dalšími body: 3 až 7.
Preparace kopulačních orgánů
Používá se pro determinaci některých druhů, u nichž nám jejich uniformita ztěžuje zařazení do druhu či poddruhu. V těchto případech preparujeme samčí kopulační orgán, který je obklopen zvláštním chitinovým obalem s charakteristickými špičkami a vnitřním vakem. Samičí genitálie se preparují také, jejich anatomie však není zdaleka tak dobře zdokumentována jako je tomu u samčích orgánů.
Preparace samčího kopulačního orgánu jde u většiny exemplářů po určitém zácviku poměrně snadno. Exempláře, které podrobujeme preparaci kopulačních orgánů, musí být dobře rozvlhčené.
U větších druhů postupujeme tak, že mezi poslední sternit a tergit zadečku vsuneme mírně zahnutou preparační jehlu a celý kopulační orgán opatrně vytlačíme ven.
U malých druhů provádíme preparaci pod mikroskopem a místo preparační jehly používáme ty nejmenší entomologické špendlíky (000) nebo minuciové jehličky, zasazené do tenkých násadek.
V některých případech je však nutné odtrhnout poslední články zadečku (8 - 10. abdominální segment). Vyjmutý kopulační orgán se obvykle vyvaří v 10% roztoku KOH nebo NaOH, čímž dojde k rozpuštění blanitých částí a zůstane čistý aedeagus: Ten po omytí destilovanou vodou a vysušení obvykle lepíme na štítek k hlavnímu preparátu. Alternativně ho můžeme uložit do glycerolu v uzavřené plastové trubičce (0,5 ml eppendorf), kterou napíchneme na špendlík k hlavnímu preparátu nebo z něj vytvoříme samostatný mikroskopický preparát.
Postup preparace malých exemplářů, publikovaný v Západočeských entomologických listech:
Milan Boukal & Karel Rébl: Clambus gibbulus – první nález pro Českou republiku (Coleoptera: Clambidae), Západočeské entomologické listy (2011), 2: 37−40
|
Preparace a disekce samčích genitálií je díky malé velikosti brouků rodu Clambus značně svízelná, pracná a vyžaduje určité zkušenosti, neboť neopatrnou manipulací nezřídka dochází až k rozpadu velmi křehkého imaga. Osvědčilo se nám jemně uchopit brouka do dvou prstů břišní stranou nahoru a oddělit (odtrhnout) celý zadeček tvrdou hodinářskou pinzetou. Celý postup je nutno provádět pod binokulární lupou. Použití tenkého špendlíku k oddělování zadečku není vhodné, zvláště ne na podložce, protože pak velmi často dochází k odpadnutí krovek a obvykle i hlavy spolu se štítem. Pro vyjmutí samčích genitálií je výhodné umístit celý zadeček do malé kapky glycerinu, a to nejlépe na matnicovém skle (tj. sklo s upraveným povrchem skla např. metodou pískování, leptáním apod.). Matnicové sklo se při preparacích za použití binokulární lupy či mikroskopu využívá z důvodu, že zabraňuje protáčení drobných přitisknutých manipulovaných částí lépe než sklo hladké. Jedním entomologickým špendlíkem přitiskneme v kapce glycerinu zadeček na matnicové sklo a druhým opatrně roztrhneme blanité tergity. Při provádění této operace na podložce „nasucho“, tj. bez glycerinu, by mohlo dojít k odskočení celého zadečku a vzhledem k jeho nepatrné velikosti i ke ztracení. Použití malé kapky vody není vhodné, protože na rozdíl od glycerinu velmi rychle vysychá, zvláště máme-li u mikroskopu silné osvětlení vydávající teplo. Vypreparovaný aedeagus entomologickými špendlíky opatrně očistíme a umístíme přímo vedle brouka na štítek do kapičky plně vodou rozpustné umělé pryskyřice di-methyl-hydatoin-formaldehydu [DMHF, (C6H10N2O3)X]. Aedeagus natočíme do vhodné polohy pro determinaci a pryskyřici necháme několik minut až hodin zatuhnout. Žádné prosvětlování aedeagu pak již není nutné. Pro bezobratlé živočichy poprvé navrhl použití DMHF STEEDMAN (1958) a po něm upravovali metodiku s ohledem na specifika brouků různých čeledí např. ANGUS (1969), BAMEUL (1990) a další. Oproti řadě dalších umělých pryskyřic má DMHF výhodu v tom, že vkládané objekty není nutno převádět přes lihové a xylenové řady nebo používat speciální rozpouštědla (izopropanol, xylen apod.). Před umístěním malých aedeagů do DMHF není nutné ani jejich proprání ve vodě (i glycerin je kompatibilní s DMHF, viz BAMEUL 1990). Při případných dalších manipulacích také později oceníme, že DMHF je zpětně kdykoli bezezbytku rozpustný vodou. Přesto řada sběratelů stále využívá k uložení aedeagu levnější, avšak složitější či časově zdlouhavější způsoby, např. za použití chloralhydrátu, euparalu, solakrylu či kanadského balzámu, případně různé trubičky s glycerinem připichované pod štítek s broukem atd. Tyto odlišné způsoby mají opodstatnění spíše při ukládání genitálií samičích. |
Preparace larev
Larvy brouků preparujeme buď jako tekutinové preparáty ve skleněných lahvích, do kterých umisťujeme menší epruvety nebo na sucho.
Tekutinové preparáty
Tekutinové preparáty pořizujeme následujícím způsobem. Larvy spaříme na cedníku horkou destilovanou vodou a postupně je převádíme přes alkoholovou řadu (50%, 70%, 80%) do 80% alkoholu nebo je dáváme hned z vody do 4% formaldehydu. Uložíme je do epruvety, opatřené lokalitními údaji a tu vložíme do širokohrdlé zásobní lahve. Epruveta i zásobní lahev je naplněna konzervační tekutinou (80% etanol nebo 4% formaldehyd). Epruvetu uzavřeme chomáčkem buničité vaty a obrácenou dnem vzhůru ji vložíme do zásobní lahve.
Suché preparáty
Suché preparáty pořizujeme následujícím způsobem. Usmrcené larvy na boční nebo na břišní straně nařízneme a zbavíme je zažívací trubice. Poté je zformované do požadovaného tvaru vložíme na cca půl hodiny do acetonu a necháme zaschnout. Alternativně můžeme velké broučí larvy po vyjmutí všech vnitřností vycpat vatou, zformovat do požadovaného tvaru a nechat uschnout.
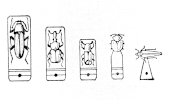
Preparace uzavřením do vzduchové komůrky
Preparaci provádíme podle standardního postupu pro preparaci vysušením až do bodu 4.
Připravíme si čisté mikroskopické podložní sklo standardní velikosti 76 x 26 mm. Doprostřed podložního skla naneseme pomocí entomologického špendlíku mikrokapku lepidla Herkules (velikost kapky řídíme podle velikosti exempláře). Pomocí pinzety nebo navlhčeného štětečku (podle velikosti exempláře) přeneseme exemplář na kapku lepidla. Pracujeme tak, aby kapka lepidla přidržovala oblast mezi kyčlemi prvního a druhého páru nohou. Počkáme cca 10 minut, až lepidlo dostatečně zaschne. Potom doupravíme chodidla, tělo, hlavičku, tykadla, kusadla a mandibuly tak, aby byl exemplář v přirozené podobě, jako při lezení. Pokud jsme vypreparovali kopulační orgány, nalepíme je do na sklo vedle exempláře.
Jako ochranu před prachem umístíme sklo s preparátem do menší papírové krabice na preparační podložku a upevníme mezi několik špendlíků. Připevníme lístek s lokalitními údaji, krabici uzavřeme a necháme při pokojové teplotě cca týden vysychat.
Po dokončení sušící fáze nalepíme okolo preparátu fíbrový kroužek, čímž vytvoříme stěny budoucí komůrky. Kroužek nalepujeme doprostřed podložního sklíčka pomocí lepidla Herkules. Sílu kroužku volíme podle výšky exempláře. V případě potřeby lze na sebe nalepit i více kroužků a udělat tak komůrku dostatečně vysokou.
Lakovou komůrku uzavřeme tak, že k fíbrovému kroužku přilepíme lepidlem Herkules čisté krycí sklíčko. Po zaschnutí krycího sklíčka (po 24 hodinách) ohraničíme 3 strany komůrky smršťovací folií a ze 4 strany vyplníme vnější část komůrky přípravkem Solakryl BMX. Solakryl nalíváme velmi pomalu, aby se stačil zcela vyplnit celý prostor mezi fíbrovým kroužkem a smršťovací folií. Hustotu Solakrylu můžeme upravit ředěním xylenem. Solakryl necháme dobře zaschnout (cca 24 hodin). Po zaschnutí odstraníme smršťovací folii a pomocí žiletky nebo skalpelu odstraníme případné zbytky na podložním skle. Vyrobíme lokalitní štítek o velikosti 26 x 26 mm, který nalepíme průhlednou lepicí páskou na levou stranu podložního skla. Po určení druhu vyrobíme determinační štítek o velikosti 26 x 26 mm, který nalepíme průhlednou lepicí páskou na pravou stranu podložního skla. Zatímco lokalitní štítek musíme k exempláři dodat ihned, determinační štítek můžeme přidat později (po determinaci exempláře). Takto vypreparovaný exemplář nakonec přemístíme do úložného boxu pro mikroskopické preparáty.
Při tomto typu preparace není nezbytně nutné uzavírat komůrku přípravkem Solakryl. Po uzavření komůrky pomocí lepidla Herkules můžete doplnit lokalitní a determinační štítky a exemplář uložit do boxu pro mikroskopické preparáty rovnou. Komůrka vytvořená s přípravkem Solakryl je však více chráněná, zejména proti mechanickému poškození.
Tento typ preparace těch nejmenších exemplářů je, díky vynikající ochraně preparovaného exepláře, vhodný především pro preparaci vzácnějších nebo typových exemplářů. Jeho provedení je však pracnější ve srovnání s preparací pomocí nalepovacích štítků.